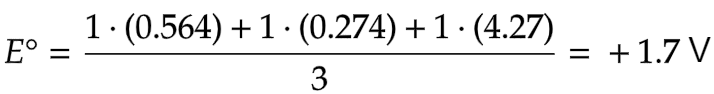12. Minggu 12: Elektrokimia.
12.1 Pengertian Elektrokimia
Elektrokimia adalah cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dan energi listrik. Bidang ini mempelajari bagaimana reaksi kimia dapat diinduksi, dikendalikan, atau diubah melalui penggunaan energi listrik atau bagaimana reaksi kimia dapat menghasilkan energi listrik. Elektrokimia melibatkan reaksi redoks (reduksi-oksidasi) yang melibatkan transfer elektron antara zat kimia.
12.2 Jenis-Jenis Sel Elektrokimia
- Sel volta.
- Sel elektrolisis.
12.3 Sel Volta
Sel volta merupakan sel elektrokimia yang dapat menghasilkan energi listrik yang disebabkan oleh terjadinya reaksi redoks yang spontan.
Contoh sel galvani:
- 12.3.1 Sel Daniell
Sel Daniell, juga dikenal sebagai sel Volta atau sel Zn-Cu, adalah salah satu jenis sel elektrokimia yang ditemukan oleh ilmuwan Inggris, John Frederic Daniell, pada tahun 1836. Sel Daniell merupakan salah satu jenis sel galvani, yang menghasilkan energi listrik melalui reaksi redoks antara dua elektroda yang terendam dalam larutan elektrolit.
Sel Daniell terdiri dari dua elektroda, yaitu elektroda seng (Zn) dan elektroda tembaga (Cu), yang terendam dalam larutan elektrolit yang sesuai. Elektroda seng dicelupkan dalam larutan seng sulfat (ZnSO₄), sedangkan elektroda tembaga dicelupkan dalam larutan tembaga sulfat (CuSO₄). Larutan elektrolit ini berperan penting dalam memungkinkan aliran ion-ion.
Reaksi kimia yang terjadi dalam sel Daniell adalah sebagai berikut:
Pada elektroda seng (anoda): Zn(s) → Zn²⁺(aq) + 2e⁻ (reaksi oksidasi)
Pada elektroda tembaga (katoda): Cu²⁺(aq) + 2e⁻ → Cu(s) (reaksi reduksi)
Terjadi pengendapan Cu dari Cu²⁺ dalam larutan.
Selama reaksi redoks tersebut, elektron dilepaskan oleh elektroda seng (anoda) dan bergerak melalui sirkuit eksternal ke elektroda tembaga (katoda). Aliran elektron ini menghasilkan arus listrik yang dapat digunakan untuk melakukan kerja.
Selama proses ini, ion Zn²⁺ dari larutan seng sulfat bergerak menuju elektroda tembaga, sedangkan ion Cu²⁺ dari larutan tembaga sulfat bergerak menuju elektroda seng. Ini memastikan bahwa terdapat kesetimbangan muatan di dalam sel.
- 12.3.2 Sel galvani
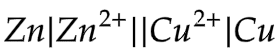
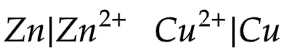
Garis tunggal menyatakan perbedaan fasa.
Garis ganda menyatakan perbedaan elektroda.
Garis putus-putus menyatakan adanya jembatan garam pada sel elektrokimia. Jembatan garam diperlukan bila larutan pada anoda & katoda dapat saling bereaksi.
- 12.3.3 Sel Volta (Sel Kering/Sel Leclance)
Katoda karbon; anoda Zn
Elektrolit: Campuran berupa pasta yaitu 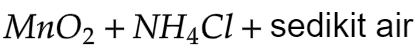
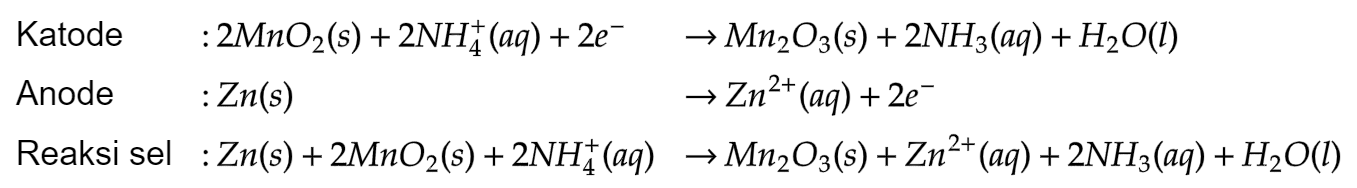
- 12.3.4 Sel Volta (Sel Aki)
Katoda: 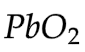
Anoda: Pb
Elektrolit: larutan 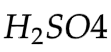
Reaksi pengosongan aki adalah sebagai berikut:
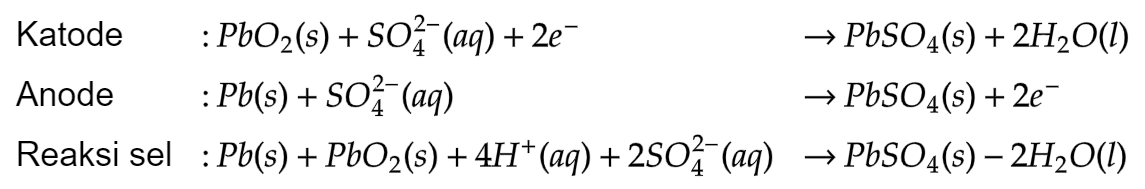
- 12.3.5 Sel Volta (Sel Bahan Bakar)
elektroda: Ni
Elektrolit: Larutan KOH
Bahan bakar: H2 & O2
Reaksi yang terjadi pada sel bahan bakar adalah sebagai berikut:
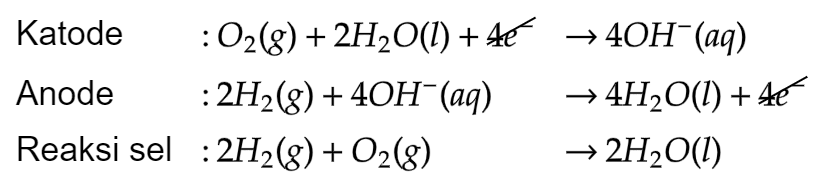
Sel hidrogen oksigen.
- 12.3.6 Sel Volta (Baterai Ni-Cd)
Katoda: NiO2 dengan sedikit air
Anoda: Cd
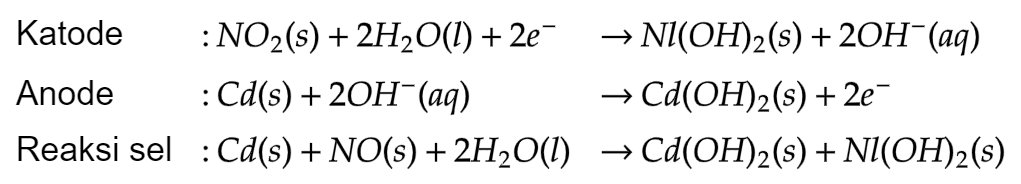
12.4 Sel Elektrolisis
Sel elektrolisis adalah sel elektrokimia yang menghasilkan redoks dari energi listrik.
12.4.1 Katoda (+)
Ion positif akan mengalami reduksi kecuali kation (+) yang berasal dari logam IA, IIA, dan Mn dalam larutan air tidak mengalami reduksi, yang mengalami reduksi adalah H2O
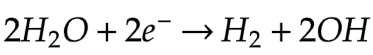
Ion logam IA, IIA.Al, dan Mn berbentuk lelehan (leburan) akan mengalami reduksi.
12.4.2 Anoda (-)
Ion negatif akan mengalami oksidasi jika elektrodanya nonaktif (Pt dan C). Ion negatif yang mengandung 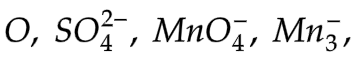 dll.
dll.
Yang tidak mengalami oksidasi adalah H2O.
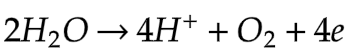
Elektrode anode merupakan logam aktif (selain Pt dan C) yang mengalami Oksidasi.
12.4.3 Elektroda
Eletroda dalam sel elektrokimia dapat disebut sebagai anoda atau katoda.
Anoda merupakan elektroda di mana elektron datang dari sel elektrokimia sehingga oksidasi terjadi.
Katoda merupakan elektroda dimana elektron memasuki sel elektrokimia sehingga reduksi terjadi.

12.4.4 Potemsial Elektroda
Potensial elektroda merupakan ukuran terhadap besarnya kecenderungan suatu unsur untuk melepaskan atau mempertahankan elektron.
Potensi elektroda tergantung pada:
- Jenis elektroda
- Suhu
- Konsentrasi ionnya
12.4.5 Menghitung potensial elektroda sel
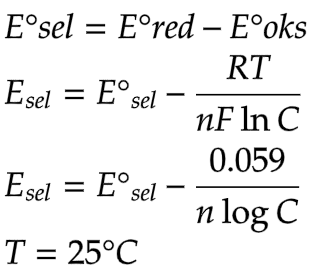
E = potensial reduksi standar (volt).
R = tetapan gas = 8.314 (volt.coulomb)/(mol.Kelvin).
T = suhu mutlak (K).
n = jumlah elektron.
F = 96500 coulomb.
C = (bentuk oksidasi) / (bentuk reduksi).
12.4.6 Potensial Elektroda Standar
Merupakan potensial yang terkait dengan setengah reaksi yang ada (wadah elektroda) dan biasanya ditulis dalam setengah reaksi reduksi.
Bentuk oksidasi + ne → bentuk tereduksi 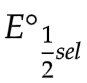

12.4.7 Elektroda Hidrogen Standar
12.4.8 Diagram latimer
Beberapa soal terkait penentuan potensial reduksi standar dapat ditentukan dengan beberapa cara. Salah satu caranya adalah menggunakan diagram latimer. Brikut ini adalah diagram latimer Mn dalam suasana asam.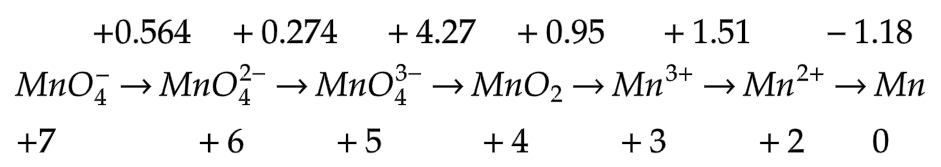
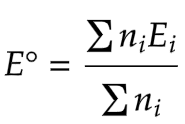
ni = elektron pada reaksi ke-i (perubahan biloks unsur yang ditanya).
Ei = potensial reduksi standar pada reaksi ke-1.
12.5 Contoh Soal
Dengan menggunakan diagram latimer, hitunglah potensial reduksi dari 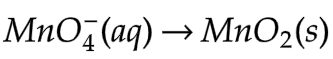 .
.
Penyelesaian:
Dengan menggunakan data diagram latimer itu dapat dihitung potensial reduksi dari 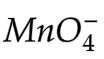 yang biloksnya +7 menjadi MnO2 yang biloksnya +4.
yang biloksnya +7 menjadi MnO2 yang biloksnya +4.